Kunci Jawaban
30 Latihan Soal dan Jawaban UAS UTS Kimia Kelas 11 Beserta Pembahasan Soal Pilihan Ganda Tahun 2024
Berikut 30 pembahasan soal UAS PAS mapel Kimia kelas 11 SMA, lengkap dengan kisi-kisi dan kunci jawaban.
TRIBUN-BALI.COM, DENPASAR - Berikut 30 pembahasan soal UAS PAS mapel Kimia kelas 11 SMA, lengkap dengan kisi-kisi dan kunci jawaban.
Contoh Soal UTS Kimia Kelas 11
Contoh Soal UAS Kimia Kelas 11
Artikel ini akan memudahkanmu dalam mengerjakan ujian soal-soal Kimia.
Mengerjakan soal Kimia Kelas 11 tak sulit lagi dengan ulasan ini.
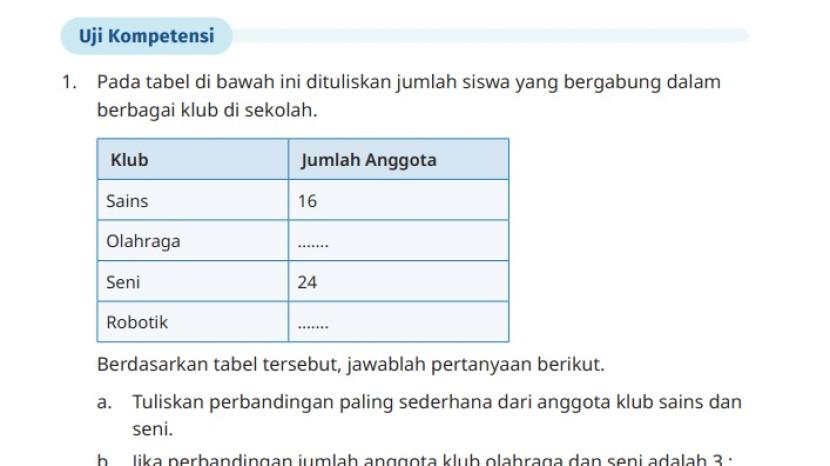
Baca juga: Soal Matematika Kelas 7 Semester 2 Halaman 58 59, Kunci Jawaban Uji Kompetensi Bab 5: Soal Uraian
Berikut kunci jawaban yang berhasil dirangkum TribunBali.com dari berbagai sumber.
Penilaian Tengah Semester (PTS) atau Ujian Tengah Semester (UTS) akan dimulai pada awal Minggu bulan Maret.
Oleh karena itu, siswa dianjurkan untuk mempersiapkan diri dalam mengerjakan soal-soal ujian agar mendapatkan hasil yang lebih maksimal.
Oleh karena itu, TribunBali sejumlah beberapa soal yang dapat membantu siswa dalam mempersiapkan diri sebelum dimulainya ujian.
Simak ulasan dan kunci jawaban selengkapnya di sini.
Kunci Jawaban UTS/PTS Kimia kelas 11
Pilihan Ganda
1. Campuran larutan di bawah ini yang dapat membentuk campuran penyangga adalah .....
A. larutan HCl dengan larutan NH4Cl
B. larutan CH3COOH dengan larutan C6H5COOK
C. larutan C2H5OH dengan larutan C2H5ONa
D. larutan Ca(OH)2 dengan larutan CaCl2
E. larutan HCOOH dengan larutan HCOONa
Jawaban: E
2. Campuran berikut ini yang dapat membentuk larutan penyangga adalah .....
A. 100 mL NaOH 0,1 M + 100 mL HCl 0,1 M
B. 100 mL NaOH 0,1 M + 100 mL NaCN 0,1 M
C. 100 mL NaCN 0,1 M + 100 mL HCN 0,1 M
D. 100 mL NH4OH 0,1 M + 50 mL H2SO4 0,1 M
E. 100 mL K2SO4 0,1 M + 50 mL H2SO4 0,1 M
Jawaban: D
3. Kesetimbangan yang terjadi dalam reaksi kimia merupakan kesetimbangan dinamis. Hal ini menunjukkan bahwa .....
A. Laju reaksi pembentukan produk tidak sama dengan laju pembentukan reaktan
B. Secara mikroskopis reaksi berhenti dan konsentrasi zat-zat tetap
C. Selalu ada perubahan menuju produk dan perubahan kembali menjadi reaktan
D. Secara makroskopis reaksi berjalan terus menerus dan konsentrasi tetap
E. Konsentrasi zat-zat pereaksi sama dengan konsentrasi zat hasil reaksi (produk)
Jawaban: E
Baca juga: Kunci Jawaban Bahasa Indonesia Kelas 12 Halaman 212, Kegiatan 2: Konstruksi Esai
4. Sebanyak 4 mol gas N2O4 dipanaskan dalam suatu ruangan sehingga 50 persen terdisosiasi membentuk gas NO2 dengan reaksi sebagai berikut:
N2O4 (g) ⇄ 2 NO2 (g)
Jika diketahui tekanan total campuran adalah 5,5 atm maka harga Kp pada suhu itu adalah .....
A. 4
B. 6
C. 8
D. 10
E. 12
Jawaban: C
5. Faktor-faktor yang tidak berpengaruh terhadap kesetimbangan kimia adalah perubahan .....
A. Konsentrasi pereaksi
B. volume ruang
C. konsentrasi katalis
D. tekanan ruang
E. suhu ruang
Jawaban: C
Baca juga: Kunci Jawaban Bahasa Indonesia Kelas 12 Halaman 211, Bagian Tugas: Deskripsi Singkat Karya
6. Pada reaksi kesetimbangan di atas:
Kesetimbangan system akan bergeser kekiri apabila .....
A. Tekanan di perbesar
B. suhu diturunkan
C. suhu di naikkan
D. volume di perkecil
E. pereaksi di tambah
Jawaban: B
7. Diketahui reaksi kesetimbangan sebagaimana diatas.
2SO3(g) ⇆ 2SO2(g) + O2(g) ∆H = +150 kj/mol
Jika suhu diturunkan, konsentrasi .....
A. SO3 tetap
B. SO3 bertambah
C. SO3 dan O2 tetap
D. SO2 tetap
E. O2 bertambah
Jawaban: B
8. Dari reaksi kesetimbangan dibawah ini yang akan bergeser ke kanan jika tekanan di perbesar adalah .....
A. 2Hl(g) ⇆ H2(g) + I2(g)
B. N2O4(g) ⇆ 2NO2(g)
C. CaCO3(s) ⇆ CaO(s) + CO2(g)
D. 2NO(g) + O2(g) ⇆ 2NO2(g)
E. S(s) + O2(g) ⇆ SO2(g)
Jawaban: D
9. Asam dan basa merupakan dua senyawa kimia yang sangat penting dalam kehidupan sehari-hari. Sifat asam dan basa dari suatu larutan dapat dijelaskan menggunakan beberapa teori. Menurut Arrhaenius, asam adalah .....
A. Senyawa yang mengandung hydrogen dan larut dalam air
B. Zat yang dalam air akan menjadi donor proton
C. Zat yang larutannya dalam air melepaskan ion H+
D. Senyawa yang bereaksi dengan air menghasilkan ion H3O+
E. Senyawa yang mampu mengikat ion H+ didalam air
Jawaban: C
10. Nilai pH Larutan basa lemah NH4OH 0,1 M dan Kb = 10-5 adalah .....
A. 9
B. 10
C. 11
D. 12
E. 13
Jawaban: C
11. Sifat larutan garam yang terhidrolisis dapat dikelompokkan berdasarkan jenis asam dan basa pembentuknya. Jika suatu asam kuat di campur dengan basa lemah, maka akan terbentuk larutan garam yang bersifat .....
A. Asam jika Ka > kb
B. Basa jika Ka < kb>
C. netral
D. asam
E. basa
Jawaban: D
12. Berikut adalah beberapa larutan.
(1) NaCl
(2) Na2CO3
(3) KCN
(4) (NH4)2SO4
(5) Mg2SO4
Pasangan garam yang pH- nya lebih besar dari 7 ditunjukkan oleh nomor .....
A. 1 dan 2
B. 1 dan 3
C. 1 dan 4
D. 2 dan 3
E. 3 dan 5
Jawaban: A
13. Pernyataan yang benar tentang larutan penyangga adalah .....
A. mempertahankan pH sistem agar tetap
B. memiliki komponen asam dan basa yang selalu berupa pasangan konjugasi
C. memiliki kapasitas tertentu
D. pengenceran tidak mengubah konsentrasi ion H+ dan OH–
E. mampu mengatasi penambahan asam dan basa dalam jumlah banyak
Jawaban: A
14. Dibawah ini yang merupakan pengertian titrasi asam basa adalah .....
A. Titrasi yang didasarkan pada reaksi ionisasi larutan
B. Titrasi yang didasarkan pada volume larutan
C. Titrasi yang didasarkan pada konsentrasi larutan
D. Titrasi yang didasarkan pada reaksi asam basa
E. Titrasi yang didasarkan pada perubahan warna larutan asam
Jawaban: C
15. Seorang siswa sedang melakukan percobaan titrasi larutan CH3COOH dengan larutan NaOH dan menggunakan indikator fenolftalein, titik akhir titrasi dicapai bila .....
A. dalam erlenmeyer terbentuk endapan
B. dalam erlenmeyer terbentuk gas
C. larutan dalam erlenmeyer tidak berwarna
D. warna larutan dalam erlenmeyer menjadi merah tua
E. warna larutan dalam erlenmeyer menjadi merah muda
Jawaban: E
16. Dibawah ini yang merupakan pengertian titrasi asam basa adalah .....
A. Titrasi yang didasarkan pada reaksi ionisasi larutan
B. Titrasi yang didasarkan pada volume larutan
C. Titrasi yang didasarkan pada konsentrasi larutan
D. Titrasi yang didasarkan pada reaksi asam basa
E. Titrasi yang didasarkan pada perubahan warna larutan asam
Jawaban: C
Baca juga: Kunci Jawaban Bahasa Indonesia Kelas 12 Halaman 219 Kegiatan 1: Buku Non-Fiksi Bob Sadino
17. Seorang siswa sedang melakukan percobaan titrasi larutan CH3COOH dengan larutan NaOH dan menggunakan indikator fenolftalein, titik akhir titrasi dicapai bila .....
A. dalam erlenmeyer terbentuk endapan
B. dalam erlenmeyer terbentuk gas
C. larutan dalam erlenmeyer tidak berwarna
D. warna larutan dalam erlenmeyer menjadi merah tua
E. warna larutan dalam erlenmeyer menjadi merah muda
Jawaban: E
18. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . .
a. Meningkatkan [H+] bila dimasukkan kedalam H2O
b. Menurunkan [H+] bila dimaasukkan kedalam H2O
c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
d. Menerima 1 H+ dari pasangan reaksinya
e. Memberi 1 H+ dari pasangan reaksinya
Jawaban: D
19. Kertas lakmus biru akan berubah menjadi merah, bila dimasukkan ke dalam larutan…
a. Kalium hidroksida
b. Natrium klorida
c. Barium sulfat
d. Asam klorida
e. Natrium nitrat
Jawaban: D
20. Reaksi yang tidak menghasilkan gas adalah . . . .
a. Logam magnesium dengan asam klorida encer
b. Natrium karbonat padat dengan asam sulfat encer
c. Logam besi dengan asam sulfat encer
d. Amonium klorida dengan natrium hidroksida
e. Logam tembaga dengan asam klorida encer
Jawaban: E
21. Larutan asam lemah NH4OH 0,1 M, dan Kb = 10-5, nilai pH larutan tersebut adalah… . .
a. 11
b. 3
c. 9
d. 14
e. 6
Jawaban : A
22. Asam dan basa merupakan dua senyawa kimia yang sangat penting dalam kehidupan sehari-hari. Sifat asam dan basa dari suatu larutan dapat dijelaskan menggunakan beberapa teori. Menurut Arrhaenius, asam adalah .....
A. Senyawa yang mengandung hydrogen dan larut dalam air
B. Zat yang dalam air akan menjadi donor proton
C. Zat yang larutannya dalam air melepaskan ion H+
D. Senyawa yang bereaksi dengan air menghasilkan ion H3O+
E. Senyawa yang mampu mengikat ion H+ didalam air
Jawaban: C
23. Nilai pH Larutan basa lemah NH4OH 0,1 M dan Kb = 10-5 adalah .....
A. 9
B. 10
C. 11
D. 12
E. 13
Jawaban: C
24. Sifat larutan garam yang terhidrolisis dapat dikelompokkan berdasarkan jenis asam dan basa pembentuknya. Jika suatu asam kuat di campur dengan basa lemah, maka akan terbentuk larutan garam yang bersifat .....
A. Asam jika Ka > kb
B. Basa jika Ka < kb>C. netral
D. asam
E. basa
Jawaban: D
25. Sebanyak 4 mol gas N2O4 dipanaskan dalam suatu ruangan sehingga 50 persen terdisosiasi membentuk gas NO2 dengan reaksi sebagai berikut:
N2O4 (g) ⇄ 2 NO2 (g)
Jika diketahui tekanan total campuran adalah 5,5 atm maka harga Kp pada suhu itu adalah .....
A. 4
B. 6
C. 8
D. 10
E. 12
Jawaban: C
26. Faktor-faktor yang tidak berpengaruh terhadap kesetimbangan kimia adalah perubahan .....
A. Konsentrasi pereaksi
B. volume ruang
C. konsentrasi katalis
D. tekanan ruang
E. suhu ruang
Jawaban: C
27. Harga pH campuran antara 100 ml larutan C6H5COOH 0,2 M dengan 100 ml larutan NaOH 0,1 M jika diketahui Ka C6H5COOH = 6 x 10-5..
a. 4 + log 6
b. 5 – log 6
c. 5 + log 5
d. 6 – log 5
e. 6 + log 6
Jawaban : B
28. Sebanyak 0,082 gram suatu garam ditambahkan ke dalam 10 ml larutan asam asetat 0,1 M (Ka = 10-5). pH yang terbentuk adalah 5. Massa molekul relatif garam tersebut adalah…gram/mol.
a. 66
b. 82
c. 83
d. 98
e. 99
Jawaban : B
29. Di antara spesi berikut manakah yang tidak berlaku sebagai asam Bronsted-Lowry…..
a. NH4+
b. H2O
c. HCO3–
d. CO32-
e. H2CO3
Jawaban: D
30. Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah . . . .
a. 2 – log 4
b. 2 + log 4
c. 2 + log 2
d. 12 + log 4
e. 12
Jawaban: A
Disclaimer
Soal yang tertera diatas merupakan latihan soal untuk persiapan UAS pada jenjang SMA MA sehingga soal bisa saja berbeda dengan UAS/PAS di sekolah masing-masing.
Soal dan pembahasan bisa saja berbeda sesuai dengan pengetahuan peserta didik sehingga harus disesuaikan dengan pengertian masing-masing siswa. (*)
Contoh Soal UAS Kimia Kelas 11
Contoh Soal UTS Kimia Kelas 11
kunci jawaban
pembahasan soal
kelas 11
Kimia
UAS
UTS
| Kunci Jawaban Bahasa Indonesia Kelas 3 SD Halaman 6 7, Kurikulum Merdeka: Cerita Lompat Tali |

|
|---|
| Kunci Jawaban Bahasa Indonesia Kelas 3 SD Halaman 3 4, Kurikulum Merdeka: Menulis Makna Kata |

|
|---|
| 50 Soal dan Jawaban UTS/UAS Antropologi Kelas 11 Pilihan Ganda Tahun 2025 |

|
|---|
| Kunci Jawaban Matematika Kelas 5 Halaman 32 35, Kurikulum Merdeka: Tepuk Bilangan Kelipatan |

|
|---|
| Kunci Jawaban Matematika Kelas 5 Halaman 27 28, Kurikulum Merdeka: Menyatakan Bilangan |

|
|---|














Isi komentar sepenuhnya adalah tanggung jawab pengguna dan diatur dalam UU ITE.